多孔質というのは、スポンジのように、細かい穴が無数にある物質のことを言います。
細かい穴があるということは、表面積が大きくなるということ。
土壌粒子や、微生物、空気と触れる面積が大きくなるということです。
物質の表面は、化学反応の「場」。
多孔質表面で起こる反応には以下のようなものがあります。
- 陽イオン交換(CEC)
- 表面のマイナスが、土壌中の表面のマイナスが、土壌中の陽イオンをつかんだり放したりする
- Ca²⁺ ⇄ K⁺ ⇄ NH₄⁺
- 反応器のプロトン化/脱プロトン化
- 表面の-OHや-COOHが H⁺ を出し入れし、pHの緩衝になる
- -COOH ⇄ -COO⁻ + H⁺
- 吸着と脱着
- 栄養・有機酸・微生物由来物質が 貼りついたり剥がれたりする
- フミン酸・アミノ酸の吸着
- 酸化還元反応
- 表面の電子状態に応じて、Fe・Mn・S・Nの形態が変化する
- NO₃⁻ → NH₄⁺, Fe³⁺ → Fe²
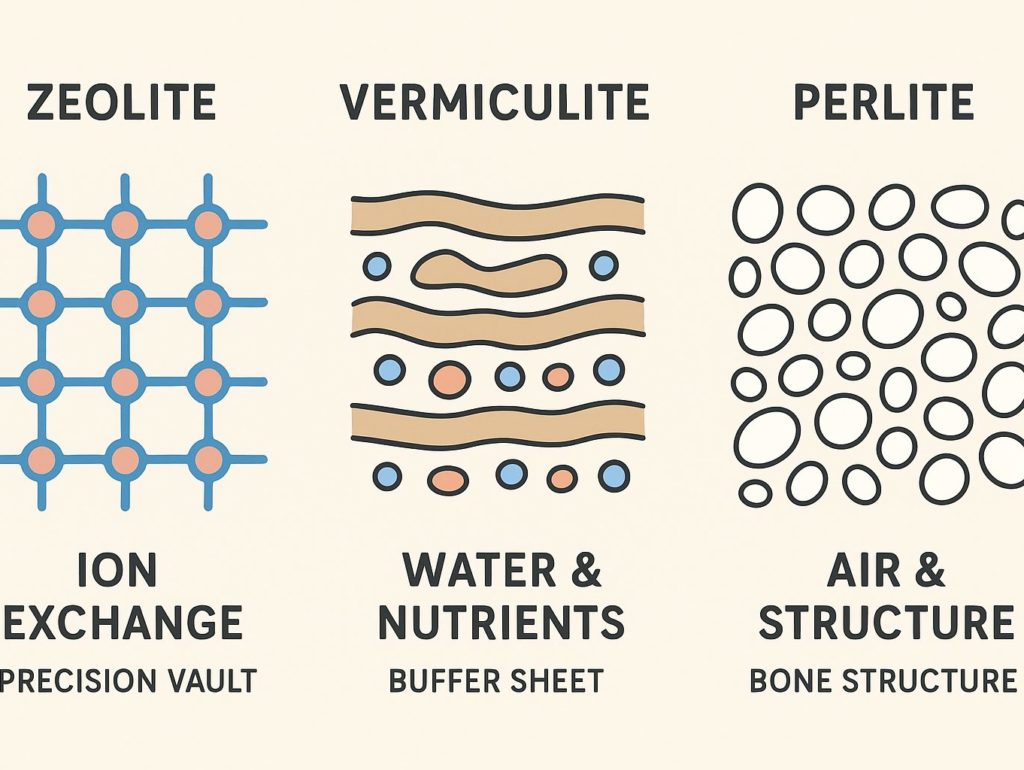
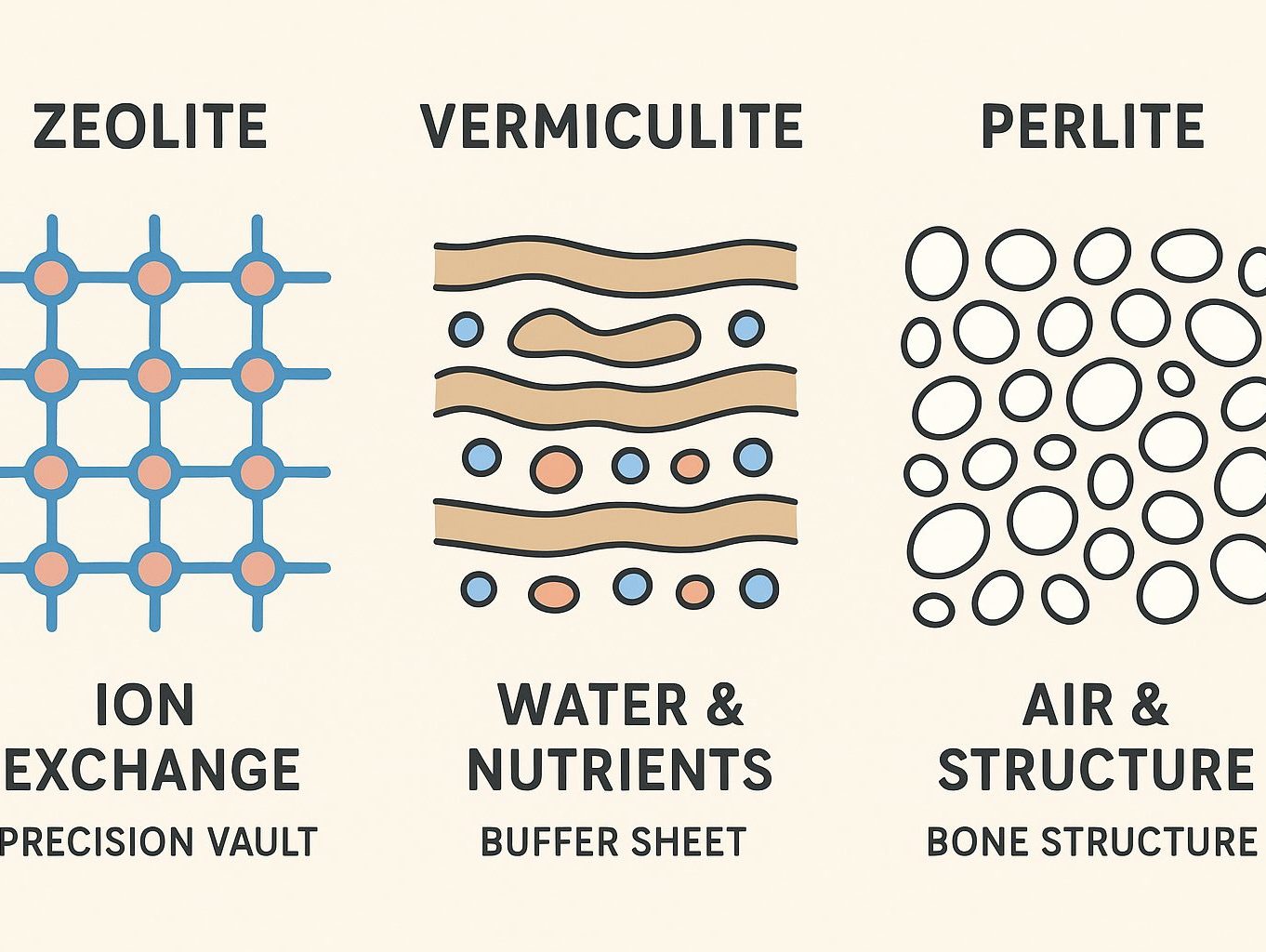
多孔質資材の性格
先日触れたゼオライトも、バーミキュライトもパーライトも多孔質構造を持つ鉱物系資材です。
しかし、全てが同じ性質を持つわけではありません。
むしろそれぞれ機能が違っていて、様々な性格を持っています。
- ゼオライト(Zeolite)
- 骨格全体に陰電荷 (−) が生じる。常時陰電荷
- CEC(80〜150 cmol(+)/kg 程度)
- 孔は 規則的で均質(0.4〜0.7 nm)
- バーミキュライト(Vermiculite)
- 層状構造のスライドできるスペースを持っている。可変陰電荷
- CEC(120–180 cmol(+)/kg)(粘土鉱物の中でも高い)
- 吸水膨張性高い。離水性緩やか(湿度緩衝材になる)
- パーライト(Perlite)
- 泡状の 物理的多孔質
- CEC(0〜3 cmol(+)/kg)
- 通気性 ↑排水性 ↑
要するに、
ゼオライトは「栄養の出し入れ」が得意
バーミキュライトは「栄養と水の保持」が得意
パーライトは「空間づくり」が得意
ということです。
ではこういった資材を、塩類集積回避のために投入できるのか。
次回、塩類集積に対する鉱物資材のはたらきについてみていきます。